避免疾病第三代非难事,看看第三代试管婴儿适合哪些人
第三代试管主要是适合一些患有遗传病的患者,它可以利用PGD/PGS对胚胎想进行筛查,找出优质的胚胎进行移植,从而就可以达到优生优育的目的。这里会有很多的朋友问道,第三代试管能不能筛查先天性心脏病、唇腭裂、癫痫、银屑病、荨麻疹、肺癌等等,从而确保小宝宝不会患病,也不会携带致病基因,其实这个答案是否定的,也就是说第三代试管并不能全部保证生下来的小孩都是健康的。
当然这里肯定也会有人发出疑问说,第三代试管中的某某技术是可以进行病症筛查的。甚至还有的人说美国是可以通过PGD/PGS筛查的,为什么国内不可以,是不是国内技术不行啊?等言论。这个我也是说不准的,我也不是专业的医生,说了也不算。但是对于很多朋友在大众渠道了解的也不算。但是借助互联网,我们可以在专业的医学论文库里找答案。
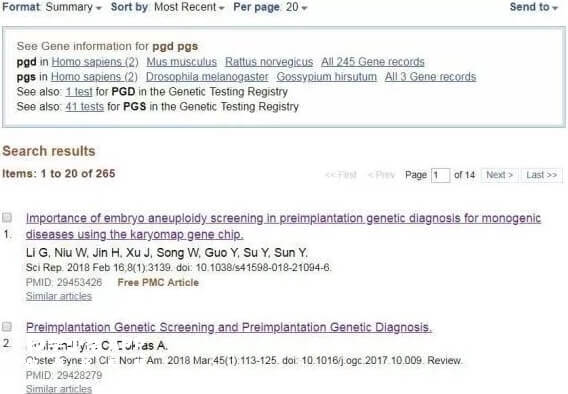
美国宾夕法尼亚大学的医学博士Dr.Sullivan-Pyke,Dr.AnujaDokras关于PGD/PGS的最新研究报告(PMID:29428279),2018年2月被SCI收录。整篇文章回顾了PGD/PGS的发展历程,每种基因测序方式的优势和局限。介绍了在准确率和适应症方面的研究新方向。
目前全面的染色体筛查平台(CCS),如阵列比较基因组杂交(aCGH)、单核苷酸多态性(SNP)芯片、定量聚合酶链反应(PCR)和新一代测序(NGS),用于植入前基因检测(PGT)。

所以继PGD/PGS这个名词之后,PGT很快将出现在大家面前。在这里我提前跟大家说明,PGT并不是更先进的技术。只是目前研究方向集中在基因层面,叫植入前genetictesting,那个T就是来源于testing的首字母。
在这里相信大家看了我前面的描述,依然是一头雾水,没有任何实质性收获。还好文章的最后,作者给出了明确结论。目前医学界公认临床上PGD/PGS能够筛查的疾病名单,主要是单基因疾病。这里也做了相对应的翻译,中英文对照如下:

在表1中出现的能够筛查的意思是:准确率、经济性、风险控制,达到了临床应用的要求。反过来,其他不能做筛查的疾病,可能是因为一下几点原因:
- 1. 准确率不稳定:您可以设想:一个医生做手术的成功率,一会儿98%,一会儿20%,那么他显然是不能给病人做手术的;
- 2. 经济性:设想有的疾病做基因筛查,需要等2年出结果,费用20万美金,还不一定准确,这种情况显然也不能临床应用;
- 3. 风险:各种未知及不可控的因素,在没有把握的情况下,都不会应用于临床。
这里要给大家再次强调一下,PGS的适应症和PGD的适应症。
- PGS的适应症是:夫妻双方没有明确遗传病及家族遗传史,针对女方高龄、不明原因流产、反复种植失败、男性不孕不育等情况。
- PGD的适应症是:父母双方确定有某种遗传病,或者家族有某种遗传病,或者得某种病的可能性比普通人大。
1、如果这种疾病在(表1)中,那么大概率是可以筛查,让您获得健康宝宝(也不含该致病基因)。好莱坞影星安吉丽娜-茱莉遗传了突变的BRCA1基因,因此患乳腺癌和卵巢癌的几率远高于正常人。2013年5月她接受了预防性的乳房切除术,以降低患癌风险,远期可能还要切除卵巢和输卵管。
而PGD/PGS能够较好的筛查这种突变,其家族子代可能不需要像她那样,在胚胎阶段就阻断这种突变基因的遗传,彻底摆脱患病的困扰。像肺癌这种,发病原因尚不清楚,主流观点认为是由多因素决定的,遗传因素占多少很难讲,是不能通过PGD筛查的。即使能筛查,在孩子出生后,婴幼儿、青少年、中老年阶段仍然可能患病,概率高低不同而已。
2、如果这种病不在上述表格中,但明确是由单基因因素导致,或者明确是常染色体显性或者隐性遗传导致。
或者我说的这些您完全不明白,就想知道xx病,会不会遗传,能不能筛查? 那么您应该咨询治疗该疾病的专科医生,同时咨询当地的具有遗传学筛查资质的生殖医院。

这里,假设我家族成员有得先天性心脏病的,我想知道在广东地区能不能做PGD/PGS筛查?
首先,带家人去广东省人民医院心外科就诊,确定具体疾病,询问是否由遗传因素导致,是否会遗传给下一代,能否给出生育建议。不管医生怎么说,只是做个参考,做手术的心外科医生并不特别清楚遗传筛查的情况。然后去中山一附院生殖中心,看遗传咨询门诊。

不同疾病子代的患病风险都不同,如果不能由PGD/PGS在胚胎阶段做筛查,但妊娠中前期依然有羊水穿刺等手段排查。具体疾病还是应该咨询医生,您需要详细摸清家族成员患病或疑似携带的情况,医生会帮您计算子代遗传概率,以便做出不同的生育对策,最大可能减少婴儿患病概率。
在看过遗传门诊之后,如果医生判断遗传风险高,且患病后严重影响生活质量,医学上不宜生育。但您一定要生,那我们只能想其他办法。如果医生判断遗传风险很低,那您就放心生,不要考虑太多。
最难的一种情况是,医生说有遗传风险,高低不好说。特别是第一个孩子已经出问题,迫切希望第二个孩子能好的父母。像唇腭裂、银屑病这种,发病原因依然不清楚,主流观点认为可能与遗传因素关联较大。以银屑病为例,相关研究发现了多达70个点位的基因关联,青少年和成人的突变情况又不同。
我们中国人非常看重基因传承,而且希望自己的孩子能100%健康,别说患病,携带都不行。现在科技那么发达,出多少钱都可以,就没有100%的办法吗?我们经常被这样的问题困扰,确实难以解释。
如果不是研究这个领域的,包括很多其他科医生在内,对基因、染色体这些概念,还停留在高中阶段。在我的学生时代,高中课本就讲了。人类基因组计划是由美国1985年率先提出,1990年正式启动的。美国、英国、法国、德国、日本和我国科学家共同参与了这一预算达30亿美元的人类基因组计划。按照这个计划的设想,在2005年要把人体内约2.5万个基因的密码全部解开,同时绘制出人类基因的图谱,揭开人体组成的终极秘密。
有点印象了对吗,这么厉害,20年过去了,怎么还没有攻克所有疾病呢?事实远远不像解题那么简单。
原发性Cardiomyopathy(CMP)是一种儿童罕见遗传病,每十万名儿童中发病率约为1.13-1.24人。有几种表型亚型包括肥厚型心肌病(HCM),扩张型心肌病(DCM)等。通过现有的基因检测技术,在有家族遗传史的人群中,确定了约1000个与HCM相关的独特变异基因,并表现出不同的性状和可变外显率。

目前能检测的部分只覆盖了所有潜在的CMP致因基因的一个子集。全基因组测序已被应用于鉴别DCM患者的罕见致病变种,他们对11名患者中的9人进行了检测,虽然获得更高的检出率,但其临床结果也严重依赖于对致病性变异的能力的准确分类,并不能产生令人满意的临床效果。
我们再来看一下,中山大学附属第一医院生殖医学中心,科主任徐艳文的最新研究报告。
统计数据
2009年Wilton等报道2538个经PCR方法诊断的PGD周期中有12个周期发生误诊,误诊率0.5%。由于PGD后移植胚胎并非都能种植,因此实际上PGD的误诊率应远高于目前报道的数据。12个误诊周期中有10个是常染色体显性遗传单基因病,2个是性连锁单基因病。10例误诊中有6例在产前诊断后终止妊娠,另外4例分娩,还有2例在出生后诊断。

误诊原因分析
12个误诊周期中分别有1例脊肌萎缩症和1例肌张力不全可能由于污染导致误诊,1例β-地中海贫血由于管标记错误而误诊,1例性别选择和1例β-地中海贫血发生ADO误诊。进行性别选择的周期还可能由于选择的Y染色体引物序列错误导致扩增失败而误诊。
另外还有2个周期误诊的原因是家系分析错误,选择了错误的STR进行诊断。其他周期未能找到明确导致误诊的原因。
最新数据
2014年ESHREPGD联盟对来自6个PGD中心的940个单基因病PGD周期中未移植胚胎重新进行诊断,通过对比原始的PGD诊断结果,计算出以PCR技术为主的PGD的准确度、敏感度(真阳性率)和特异度(真阴性率)分别为93.7%、99.2%和80.9%。59个误诊胚胎中54个假阳性,5个假阴性。假阳性减少了可移植胚胎数,其主要原因有胚胎嵌合型ADO和污染,其中胚胎嵌合型占53.7%,ADO占31.5%。5个假阴性会直接造成漏诊,分析原因均为胚胎嵌合型导致的。

分析
活检2个细胞显著提高诊断准确性,多重PCR显著提高诊断敏感性。胚胎的形态不影响诊断的准确性,但形态好的胚胎诊断的敏感性更高。另外,在单细胞进行多重PCR可以获得与2个细胞相等的假阴性率。
总结
单细胞水平的单基因疾病诊断技术虽然日趋成熟,但仍需格外谨慎和严格。任何微小的改变,如裂解液的配伍、试剂批号和新仪器等都可能对诊断有影响。
展望
近年来高通量技术开始在单基因病PGD中崭露头角,如核型定位(karyomapping)和二代测序技术。通过海量的SNP数据分析,新技术将给单基因病PGD带来革命性的变化,极大降低由于污染和ADO导致的误诊。

另外囊胚活检后增加细胞数,也可降低嵌合型造成的相关问题。但PGD基于极低样本量的本质不会改变,囊胚嵌合型仍会影响诊断的准确率。
在普通人的眼里,基因检测对于疾病诊断就像,带着一颗原子弹穿越到古代打仗的士兵,往敌阵一丢,敌人瞬间倒下。事实上基因检测像排地雷。有没有地雷不知道,如果有地雷在哪里不知道,知道在哪里,它是以何种方式爆炸不知道,并且这颗地雷还会七十二变。
总的来说在基因层面,对一种疾病诊断,要准确率和经济性达到临床要求,其难度不亚于研发一种新药攻克某种疾病。目前已知遗传病超过7000种,全世界的临床医生和科研人员,正帮大家一颗一颗排除,每一次的胜利都是人类前进的一小步。
- 1. 第三代试管婴儿技术(PGD/PGS)是什么
- 2. 做一次第三代试管婴儿大概费用
- 3. 第三代试管婴儿优点和缺点
- 4. 哪些人适合做第三代试管婴儿
- 5. 国内外第三代试管婴儿发展史
- 6. 三代试管婴儿可以筛查什么疾病
- 7. pgs与pgd的区别
- 8. 第三代试管婴儿技术的谎言
- 9. 第三代试管婴儿靠不靠谱